
��Ŀ�� ��Դ�� �}�ͣ�Ӌ(j��)���}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ���(sh��)�(y��n)̽���}
 ���W(xu��)����(y��ng)�����Ǻ������W(xu��)����(y��ng)�M(j��n)�п�����������������̽��Ӱ푻��W(xu��)����(y��ng)���ʵ����أ����^������ֽ���о���(du��)���M(j��n)�Ќ�(sh��)�(y��n)��
���W(xu��)����(y��ng)�����Ǻ������W(xu��)����(y��ng)�M(j��n)�п�����������������̽��Ӱ푻��W(xu��)����(y��ng)���ʵ����أ����^������ֽ���о���(du��)���M(j��n)�Ќ�(sh��)�(y��n)��| ԇ�� | MnO2 | �t�u��ĩ | CuO |
| t/s | 10 | 60 | 20 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ���(sh��)�(y��n)̽���}
| �F�������� | FeO | Fe2O3 | Fe3O4 |
| �F���|(zh��)����?j��n)?sh��) | 77.8% | 70.0% | 72.4% |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��Ɣ��}
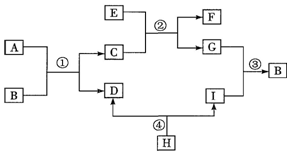
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | CH2O | B�� | CH4O | C�� | C3H6 | D�� | CH2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | Ԫ�� | B�� | ԭ�� | C�� | ���� | D�� | �x�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ����ƿ | B�� | ���P䓵� | C�� | ��]���� | D�� | ��܇݆̥ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �����ھƾ��Ƴɵ�� | B�� | ʯϞ�ۻ� | ||
| C�� | ��ʯī��ԭ�Ϻϳɽ���ʯ | D�� | ���͓]�l(f��) |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �ڢ� | B�� | �٢� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com