
��Ŀ�� ��Դ�� �}�ͣ�����}
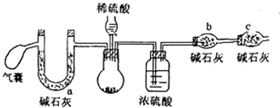 �^�����c���������w���Ĺ����������伃��Ҫ��ܸߣ�ijС�Mͬ�W(xu��)���˜y���^�����c�ļ��ȣ��s�|(zh��)��̼���c�����O(sh��)Ӌ(j��)�����·�����
�^�����c���������w���Ĺ����������伃��Ҫ��ܸߣ�ijС�Mͬ�W(xu��)���˜y���^�����c�ļ��ȣ��s�|(zh��)��̼���c�����O(sh��)Ӌ(j��)�����·�����| �������c��ȣ�mol•L-1�� | 5 | 2 | 1 | 0.01 |
| ׃�t����ɫ�ĕr(sh��)�g��s�� | 8 | 94 | 450 | �L�r(sh��)�g����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 ���Y(ji��)��(g��u)ʽ��O=C=O��
���Y(ji��)��(g��u)ʽ��O=C=O�� ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| �r(sh��)�g/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C��NO��10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C��CO��10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| ԇ�(y��n)��̖ | T/�� | NO��ʼ���/10-3mol•L-1 | CO��ʼ���/10-3mol•L-1 | �����ıȱ���e/m2•g1 |
| �� | 350 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 82 |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ��(sh��) | 1 | 2 | 3 |
| ��w�e/mL | 19.60 | 19.65 | 19.55 |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}


�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| �r(sh��)�g��s�� | 0 | 1 | 2 | 3 | 4 | �� |
| c��NO��/mol•L-1 | 1.00��10-3 | 4.00��10-4 | 1.70��10-4 | 1.00��10-4 | 1.00��10-4 | �� |

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_ | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com