
��Ŀ�� ��Դ�� �}�ͣ�����}

| ���|(zh��) | �r��/Ԫ•��-1 |
| ƯҺ����25.2%NaClO�� | 450 |
| �p��ˮ����30%H2O2�� | 2400 |
| ���A����98%NaOH�� | 2100 |
| ���A����99.5%Na2CO3�� | 600 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
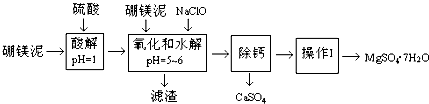
| �ضȣ��棩 | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
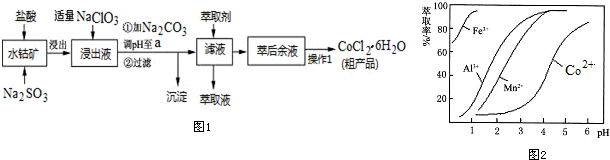
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| �_ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ���|(zh��) | H2 | CO2 | CH3 OH | H2 O |
| ��ȣ�mol/L�� | 0.2 | 0.2 | 0.4 | 0.4 |
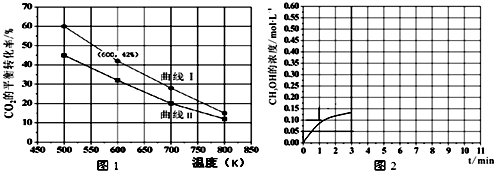
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 �t��Cr�����S��N������ڹ��I(y��)���a(ch��n)���ЏV������;��
�t��Cr�����S��N������ڹ��I(y��)���a(ch��n)���ЏV������;���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ϡ�К��w | B�� | ����Ԫ�� | C�� | ����Ԫ�� | D�� | �ǽ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
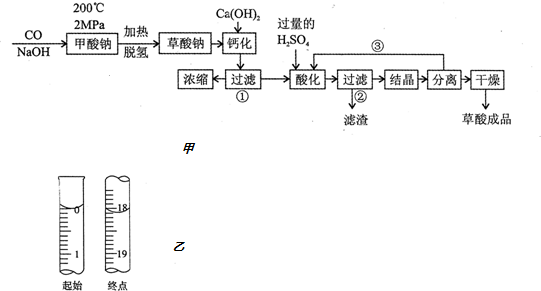
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com