
題目列表(包括答案和解析)
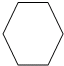
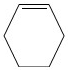
| 類 別 | 烷 烴 | 烯 烴(僅含一碳碳雙鍵) |
| 通 式 | ||
| 典型反應類型 |
| 稀硫酸 |
| △ |
| 稀硫酸 |
| △ |
| 催化劑 |
| △ |
| 催化劑 |
| △ |
| 催化劑 |
| 催化劑 |
| 催化劑 |

| 催化劑 |

| ||
| ||
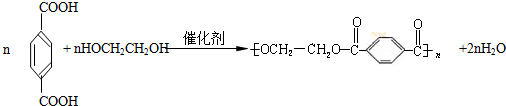
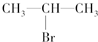 (主要產物),1mol某烴A充分燃燒后可以得到8mol CO2和4mol H2O.該烴A在不同條件下能發(fā)生如下所示的一系列變化.
(主要產物),1mol某烴A充分燃燒后可以得到8mol CO2和4mol H2O.該烴A在不同條件下能發(fā)生如下所示的一系列變化.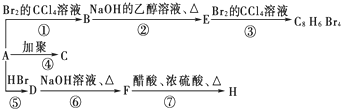
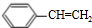
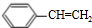
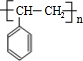

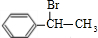
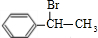
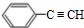

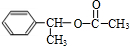
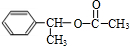
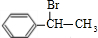 +NaOH
+NaOH| 水 |
| △ |
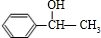 +NaBr
+NaBr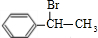 +NaOH
+NaOH| 水 |
| △ |
 +NaBr
+NaBr



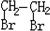





湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com